复百澳(苏州)生物医药科技有限公司
8 年
手机商铺
- NaN
- 0.7999999999999998
- 1.7999999999999998
- 0.7999999999999998
- 3.8
推荐产品
公司新闻/正文
综述丨溶瘤病毒助推免疫检查点抑制:发展现状与未来的挑战
981 人阅读发布时间:2022-11-16 08:50
2018年的诺贝尔生理学或医学奖授予了James P. Allison和Tasuku Honjo,因为他们发现了免疫检查点阻断(ICB)作为一种新的癌症治疗方法,最近这一领域的宗旨从关注直接肿瘤裂解转变为将冷肿瘤转化为热肿瘤。溶瘤病毒(OVs)被视为一种有前途的治疗平台,它们可以在癌细胞中复制并溶解癌细胞。目前,OVs的主要研究已经从通过病毒裂解杀灭癌细胞转变为高效、协调地激活宿主免疫系统。
来自武汉大学口腔医院的研究人员对现有的OVs和免疫检查点抑制剂(ICI)结合、测试ICI武装OVs的临床前和临床研究发表了综述,讨论了它们如何帮助冷肿瘤转化为热肿瘤,并进一步对OVs应用于临床的挑战提供了见解。近日,相关论文以“Fueling immune checkpoint blockade with oncolytic viruses: Current paradigms and challenges ahead”为题发表于《Cancer Letters》杂志上。

✦ + OVs的发展现状
1型单纯疱疹病毒
HSV-1是工程化OVs最主流的溶瘤病毒之一,包括已获得商业批准的T-VEC和G47Δ,用于治疗恶性黑色素瘤和胶质瘤。HSV-1可以感染多种宿主细胞,使其成为一种潜在的广谱抗癌剂。其较大的有效载荷容量使得能够插入编码各种免疫支持因子的多个非病毒基因。已经报道了多种遗传修饰的HSV-1,在临床试验中评估的包括T-VEC、HF10、G207、G47Δ、OrienX010、HSV1716和NV1020。
延伸:
腺病毒
与HSV-1相似,腺病毒可以感染广泛的细胞。对腺病毒基因组遗传操作的成熟性,及其极好的物理化学稳定,便于产生高滴度的病毒库。目前,ONYX-015的子代产物H101仍是中国卫生监管部门批准上市的第一款溶瘤腺病毒。在临床试验中研究的其他溶瘤腺病毒包括ICOVIR-5、ONCOS-102、CGTG-401、ONYX-15、LOAd703、VCN-01和OBP-301。
延伸:
牛痘病毒
痘苗病毒(VV),曾作为天花疫苗广泛使用,并积累了丰富的临床经验。许多转基因VVs已经在临床前模型中作为溶瘤剂进行了评估,其中一些已经进入了治疗晚期实体肿瘤患者的临床研究,包括(但不限于)前泌乳酶基因脱acirepvec (Pexa-Vec), GL-ONC1和vvDD。
新城疫病毒
新城疫病毒(NDV)在20世纪50年代首次被报道具有溶瘤作用。迄今为止,在许多病例报告和一些早期临床试验中,自然产生的NDV菌株已被证明有前景并具有良好的耐受性,但它们都没有进入三期临床试验,可能是因为监管部门担心一些NDV菌株在禽类中具有高毒性。目前,一种表达GM-CSF的重组NDV (MEDI5395)与durvalumab联合使用的研究正在进行中(NCT03889275)。
2. 通过V、F和HN基因修饰可提高新城疫病毒的用药安全及溶瘤潜力
脊髓灰质炎病毒
脊髓灰质炎病毒是小核糖核酸病毒科的一种非包膜RNA病毒。PVSRIPO作为脊髓灰质炎减毒活疫苗,显示出对复发性胶质母细胞瘤和晚期黑素瘤的治疗前景,并获得FDA授予的突破性药物称号。目前正在进行一项2期随机临床试验(NCT04577807)。
其他病毒
其他病毒如,麻疹病毒、细小病毒、呼肠孤病毒和柯萨奇病毒也在临床试验中得到了研究。MV-NIS是一种编码甲状腺碘化钠转运体(NIS)的麻疹病毒(MV)突变体,通过放射性碘的无创伤成像提供了一种监测实体肿瘤的方法,并在晚期黑素瘤患者中完成了I期临床试验。其他三种病毒(细小病毒、呼肠孤病毒和柯萨奇病毒)正在作为未经修饰的天然OVs在临床试验中进行测试,它们作为制剂的名称分别为H-1PV (ParvOryx)、Pelareorep (Reolysin®)和CVA21 (CAVATAK)。
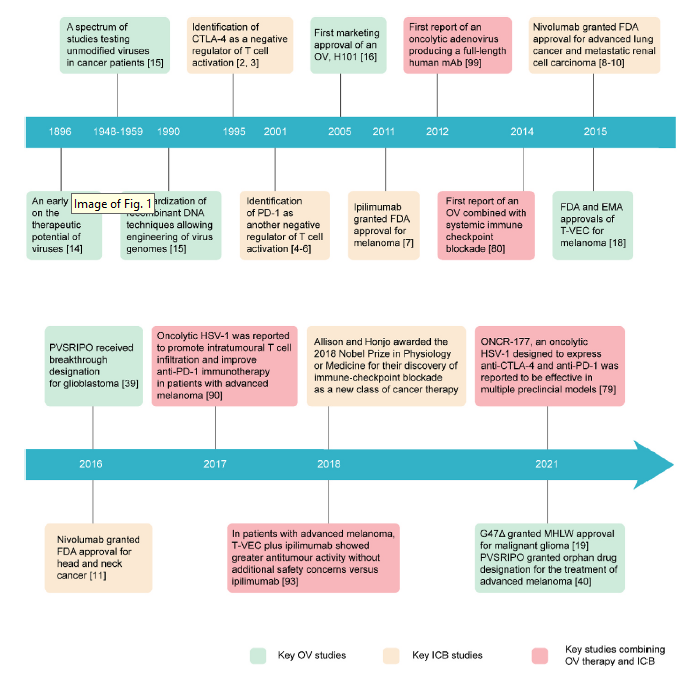
Fig1. Key OV candidates tested in clinical trials.
✦ + 溶瘤病毒作为一种免疫疗法的优势与局限性
溶瘤病毒在肿瘤微环境中的重塑免疫环境
与对ICB单药治疗较好的免疫原性热肿瘤患者相比,许多免疫原性差的肿瘤患者存在免疫原性冷肿瘤微环境(TME),包括胶质母细胞瘤、胰腺癌、卵巢癌、前列腺癌和大多数乳腺癌。冷肿瘤对ICB反应甚微,因此提出的方案:将TME重编程药物与ICB联合使用,以“激活”和重塑TME,促进抗肿瘤免疫治疗。
OVs能够重塑TME内的免疫环境,从而启动T细胞介导的抗癌免疫。在溶瘤腺病毒DNX-2401的I期研究中,经治疗后检查显示CD8+ 和T-bet+ 细胞的肿瘤浸润,强烈表明适应性免疫系统介导的抗肿瘤反应的激活。
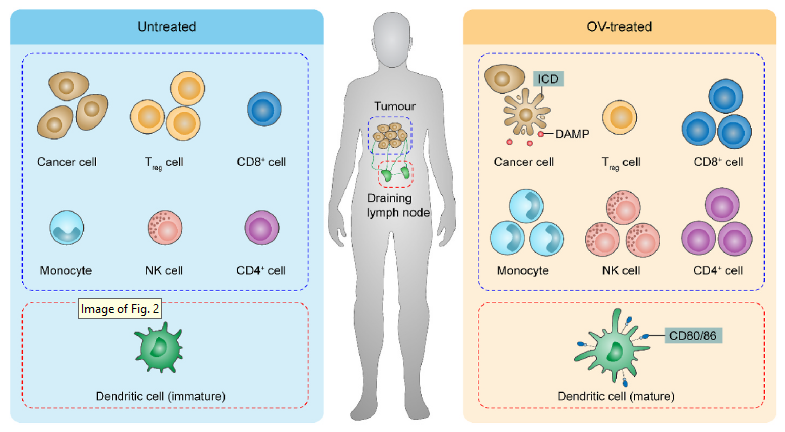
Fig2. OVs remodels the immune context within the TME.
溶瘤病毒的局限性
与其他疗法类似,OVs也有一些固有的局限性。首先,病毒因其免疫原性而被宿主免疫系统快速清除,抗病毒免疫应答抑制病毒复制和感染。其次,高免疫显性病毒抗原可能会掩盖针对肿瘤抗原产生的亚显性免疫反应,这导致病毒特异性T细胞的产生并因此在病毒治疗后快速清除病毒。还有一个限制是耐药癌细胞的存在。与野生型病毒相比,一些基因修饰的OVs更容易受到TME中干扰素介导的抗病毒免疫反应的影响。
此外,T-VEC和类似的OVs传统上被认为选择性地进入恶肿瘤细胞,但用T-VEC处理的淋巴瘤样品的单细胞测序显示,在淋巴瘤细胞和非恶性细胞中检测到相似水平的T-VEC转录物,表明非选择性T-VEC进入,需要进一步的研究来揭示OVs在其他癌症中的真实选择性。

Fig3. Limitations of oncolytic viruses.
✦ + OVs和ICI组合使用
在临床前研究中,OVs与各种检查点抑制剂的组合已证明了该策略的应用前景。该领域的一项开创性研究表明,在黑色素瘤小鼠模型中,NDV和CTLA-4的局部联合应用可以治愈预先建立的肿瘤,并保护小鼠免受肿瘤复发。在卵巢和结肠小鼠模型中证明,表达C-X-C基序趋化因子11(CXCL11)的VV增强了T细胞浸润,并上调了TME中PD-L1的表达,与单药治疗相比,联合用药显著降低了肿瘤负担并延长了小鼠生存期。
作为第一种获批的病毒免疫疗法,T-VEC已在多个临床试验中与各种检查点抑制剂联合进行了测试。在晚期黑色素瘤临床试验(MASTERKEY-265)中,肿瘤内注射T-VEC和pembrolizumab显示出良好的疗效,证实了OVs的TME重塑功能。最近发表的一项2期临床试验测试了T-VEC与pembrolizumab联合治疗晚期肉瘤,结果表明该组合在一系列肉瘤组织学亚型中具有较高客观缓解率的抗癌活性。
除此之外,OVs与CTLA-4抑制剂联合治疗也在积极研究中。在一项评估晚期黑色素瘤患者中T-VEC+ipilimumab治疗效果的研究中,表明联合治疗的疗效明显高于ICI单一治疗。
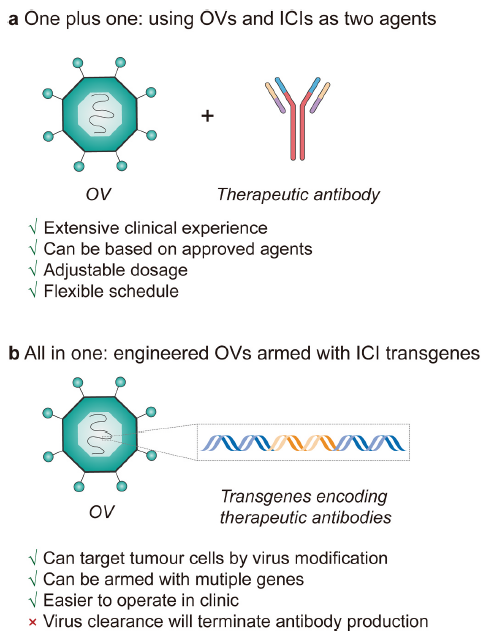
Fig4. Two ways to combine OVs with ICIs.
✦ + 携带ICI转基因的工程OVs
目前所有批准的ICI都是静脉注射,导致患者出现免疫毒性。携带ICI转基因的工程化OVs可能会诱导产生与OVs和ICI联用相当或更好的抗癌免疫性,从而减少与系统注射相关的不良反应。
迄今为止,已被设计用于表达ICI的病毒主要包括MV、腺病毒、HSV-1、VV、粘液瘤病毒和正痘病毒。例如,BT-001(TG6030)是一种工程化的溶瘤VV,用于表达人CTLA-4抗体和GM-CSF细胞因子,在小鼠肿瘤模型中显示出良好的抗肿瘤活性。第二个例子是通过用抗PD-L1抗体和人NIS组装CF33而产生的嵌合OVs(CF33-hNIS-antiPD-L1),CF33-hNIS-antiPD-L1可以感染肿瘤细胞,使其产生并释放抗-PD-L1抗体。在患有胰腺导管腺癌的小鼠模型中,单剂量瘤内注射CF33-hNIS-antiPD-L1可减少肿瘤体积并延长生存期。
一些OVs具有高负载能力,可将多种ICI整合到一种治疗剂中。最近的突出范例是ONCR-177,它是一种带有五种免疫调节基因的疱疹病毒,病灶内注射mONCR-177导致同基因双侧小鼠肿瘤模型的显著肿瘤消退。并且小鼠对同一肿瘤细胞系具有抵抗力,这表明建立了保护性记忆反应。

Fig5. Preclinical studies integrating viral immunotherapy with ICB.
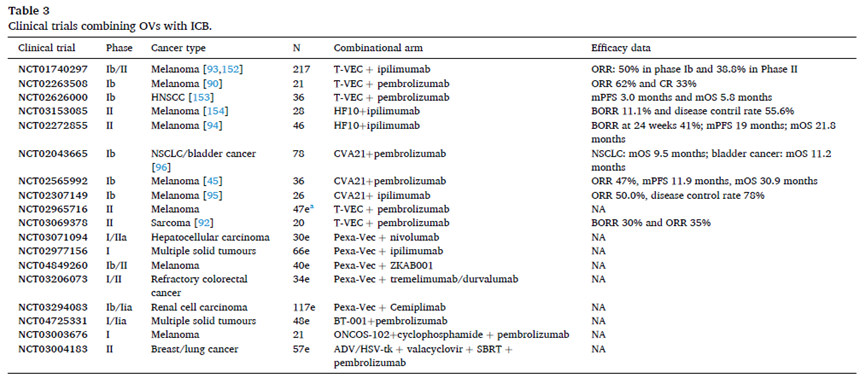
Fig6. Clinical trials combining OVs with ICB.
✦ + 机遇与挑战
尽管过去十年取得了显著进展,但ICIs和OVs之间相互作用的复杂性对选择合适的患者、递送方式、病毒骨架、武装抗体以及组合的时间和剂量等提出了要求。据报道,几种组合会产生不必要的拮抗作用,并失去抗癌活性。
实现溶瘤病毒的全身递送
为了保证系统递送的成功,OVs必须避免在进入肿瘤细胞之前被免疫屏障清除。研究发现磷脂酰肌醇3-激酶δ(PI3Kδ)是全身给药后促进溶瘤VVs巨噬细胞摄取的关键调节因子。Marelli等人使用一种PI3Kδ抑制剂idelalisib,可以保护VVs免受巨噬细胞的吞噬。
Lv等人利用生物工程细胞膜纳米囊泡(BCMNs)携带靶向配体来生产BCMN伪装的溶瘤病毒(OA@BCMNs). 体外研究表明OA@BCMNs成功地逃脱了免疫清除并在肿瘤组织中积累,能有效感染癌细胞并在其中复制。
选择最佳组装抗体
选择何种抗体在OVs局部表达也是重要的。目前,治疗性IgG抗体(IgG1-4)对免疫细胞上表达的各种FcγR受体和不同的补体(如C1q)具有不同的结合亲和力。治疗性抗体通常基于人IgG4抗体模板进行工程设计,其与FcγR的结合亲和力相对较低,以避免潜在的抗体依赖性细胞毒性(ADCC)和补体依赖性毒性(CDC)。此外,一些工程化OVs表达抗原结合片段(Fabs)或单链可变片段(scFvs),消除了Fc相关的毒性。Xu等人分别在人IgG1支架或人IgG4支架上携带编码全长抗CD47抗体的转基因,产生了两种溶瘤HSV,OV-αCD47-G1和OV-βCD47-G4。尽管OV-αCD47-G1在肿瘤内给药的情况下被证明优于OV-βCD47-G4,但当需要全身给药OVs治疗转移性肿瘤时,用IgG4抗体组装OVs可能是一种毒性较小的更好选择。
选择疗效监测的生物标志物
生物标志物可能有助于OVs治疗。目前没有普遍应用的预测性生物标志物,但有几种候选物。例如,干扰素-γ(IFNγ)可使肿瘤对OVs感染敏感。环状GMP-AMP合成酶(cGAS)及其干扰素刺激因子(STING)主要通过检测和响应致病DNA发挥作用,可作为溶瘤病毒治疗的生物标志物。
除此之外,开发生物标记物来监测患者对OVs治疗的反应和TME的重塑也获得了关注。通过病毒生物分布的成像和病毒诱导的血管变化的监测来评估TME重塑,炎症信号(如IFNγ的表达)、检查点激活信号(如PD-L1的表达)和T细胞或细胞毒性T细胞浸润水平都是候选生物标志物,表明从免疫原性冷肿瘤到热肿瘤的表型变化。肿瘤细胞死亡可以通过检测循环肿瘤DNA或各种细胞死亡标志物(如血清HMGB1水平)来监测。另外,外周血免疫细胞亚群、血清细胞因子和趋化因子水平可以作为免疫应答的系统性生物标志物。
调整治疗顺序和时间
许多临床前研究报告称,OVs和ICI给药的顺序和时间显著影响联合治疗的治疗反应。ICI和OVs的给药顺序和时间可分为六类。由于OVs主要通过将免疫抑制性TME转化为免疫支持性TME发挥作用,目前最合理的治疗方案似乎是在最初使用OVs后,OVs和ICIs的同时给药治疗。OVs维持炎性TME,ICB有助于防止PD-L1调节的T细胞衰竭。这一假设有待进一步研究验证。许多其他因素,如癌症类型、病毒类型和武装策略、药剂剂量和治疗持续时间,也可能影响联合治疗的疗效。
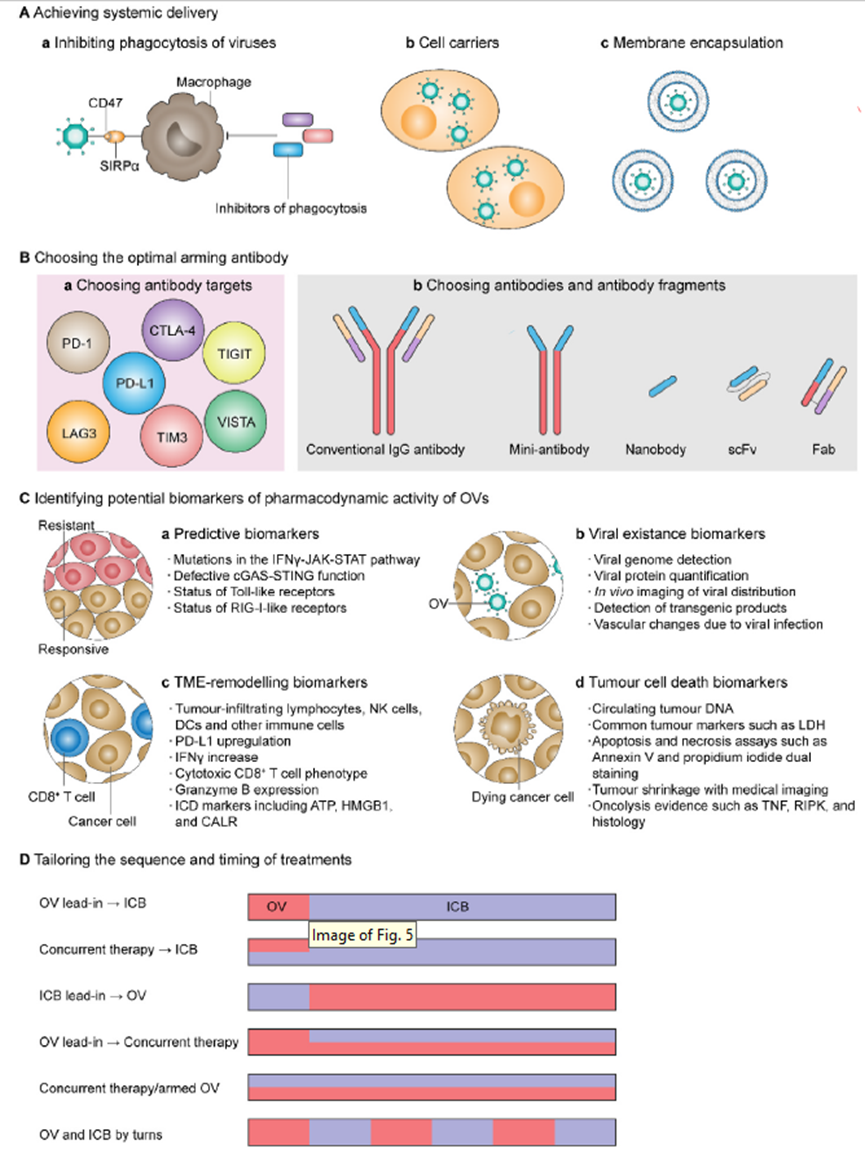
Fig7. Challenges and opportunities in fuelingimmune checkpoint blockade with oncolytic viruses.
✦ + 结论和观点
与ICI的快速发展相比,OVs的临床转化相对缓慢,使用OVs与ICB结合来增强抗癌免疫反应。重组DNA技术编辑病毒基因组以提高病毒选择性,并用将含有多种转基因编码治疗性蛋白的OVs组装起来,这些OVs可能为癌症患者提供一体化治疗。然而,这一领域仍面临许多根本性挑战,需要进行更多的基础研究。






